定期通信第68号は、2025年11月27日に、東京農業大学世田谷キャンパス内横井講堂で開催された「2025年度第2回講演会」の聴講録です。講演の概要を簡潔に取りまとめ、数枚のスライドを挿入して、ご講演をいただきました、中村 寛海 先生、守山 隆敏 先生、岡田 由美子 先生に監修をしていただいたものです。
会誌「食の安全と微生物検査」第15巻第2号の資料を合わせてご覧ください。
講演会の動画記録を会員限定ですが、Vimeoでアーカイブ配信しています。利用方法については、当法人のホームページの会員専用ページをご覧ください。
テーマ:食のリスクマネジメントにおける国際整合性
●講演1
Ready-to-eat食品製造環境におけるリステリア汚染状況とその制御について (中村 寛海 先生)
●講演2
リステリア環境モニタリングの重要性(守山 隆敏 先生)
●講演3
リステリア・モノサイトゲネスとリステリア属菌の試験法(岡田 由美子 先生)
講演1
Ready-to-eat食品製造環境におけるリステリア汚染状況とその制御について
中村 寛海
地方独立行政法人 大阪健康安全基盤研究所微生物部細菌課
地方独立行政法人 大阪健康安全基盤研究所微生物部細菌課
1. 国際整合における課題と食品安全の現状
リステリアモノサイトゲネス(LM)は、鞭毛を有するグラム陽性桿菌で、鞭毛を有し、運動性があり、芽胞および莢膜を形成しない。また、10℃以下の低温でも増殖可能という食品衛生上厄介な特徴をもつ。本菌は食品を介してヒトにリステリア症を引き起こす。リステリア症には敗血症や髄膜炎を引き起こす重篤な侵襲性リステリア症と、胃腸炎型の非侵襲性リステリア症がある。侵襲性リステリア症は致死率が高く、欧米では死者が多数出ている。
リステリア症の原因食品としては加熱せずに喫食するReady-To-Eat (RTE) 食品が最も多い。LMは加熱することにより容易に死滅するが、本菌が持つ低温増殖能や高い耐塩性、耐酸性は食品衛生上非常に問題となる特徴であり、このような特徴により多様な食品がリステリア症の原因となっている。
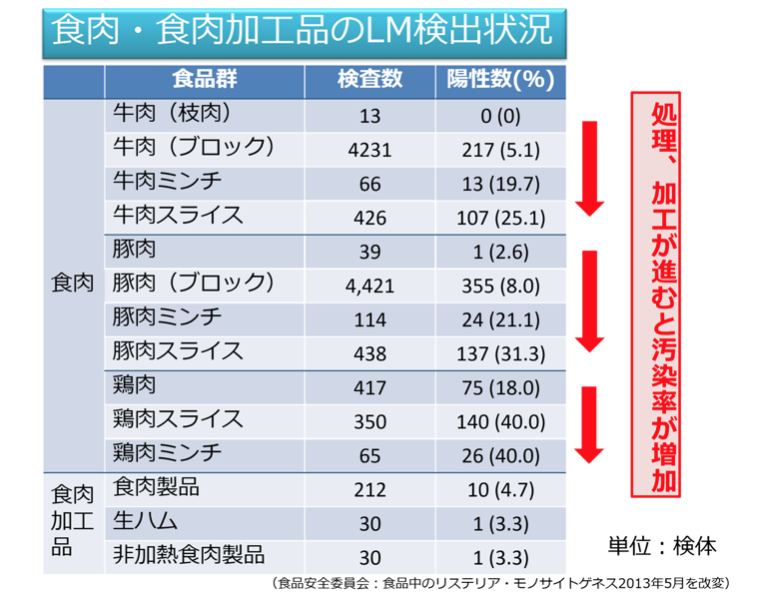 日本において、食品を原因とする侵襲性リステリア症は報告されていないが、厚生労働省院内感染対策サーベイランス(JANIS)によると2008~2011年の4年間でリステリア症患者数は307人と報告されている。そのため日本においても原因不明であるが、散髪事例として侵襲性リステリア症が発症している。食品媒介による非侵襲性リステリア症は2事例の報告がある。
日本において、食品を原因とする侵襲性リステリア症は報告されていないが、厚生労働省院内感染対策サーベイランス(JANIS)によると2008~2011年の4年間でリステリア症患者数は307人と報告されている。そのため日本においても原因不明であるが、散髪事例として侵襲性リステリア症が発症している。食品媒介による非侵襲性リステリア症は2事例の報告がある。
ヒトへの主な伝搬経路は家畜の常在菌叢からの食品汚染よりも、製造段階の環境に存在するLMによる汚染であると考えられている。食肉加工においては処理、加工が進むとLM汚染率が増加する。
 LMにはpersistent
strain(施設定着株)の存在があると考えられている。アメリカで1988年と2000年に発生した食肉製品によるリステリア症事例では、原因食品の製造元がどちらも同じであった。また、代表株のゲノム解析を実施したところ、12年経過後もゲノム構造にほとんど変化が見られなかった。
LMにはpersistent
strain(施設定着株)の存在があると考えられている。アメリカで1988年と2000年に発生した食肉製品によるリステリア症事例では、原因食品の製造元がどちらも同じであった。また、代表株のゲノム解析を実施したところ、12年経過後もゲノム構造にほとんど変化が見られなかった。
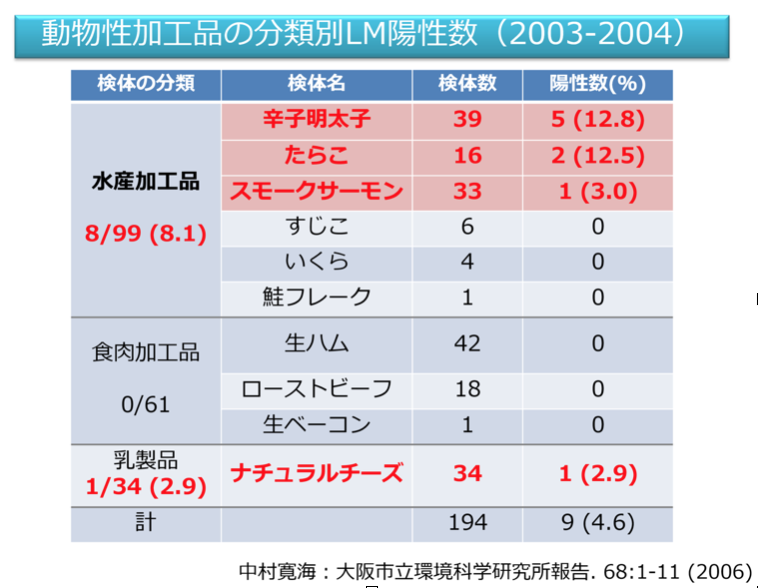
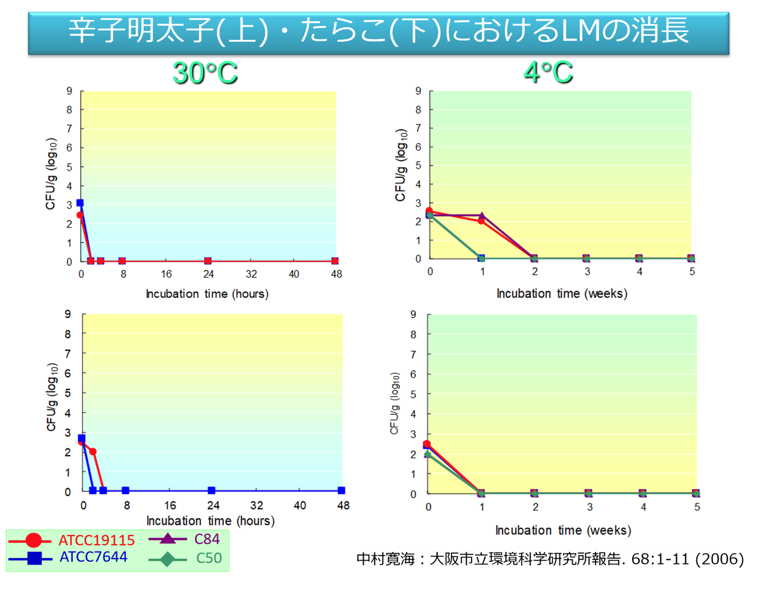
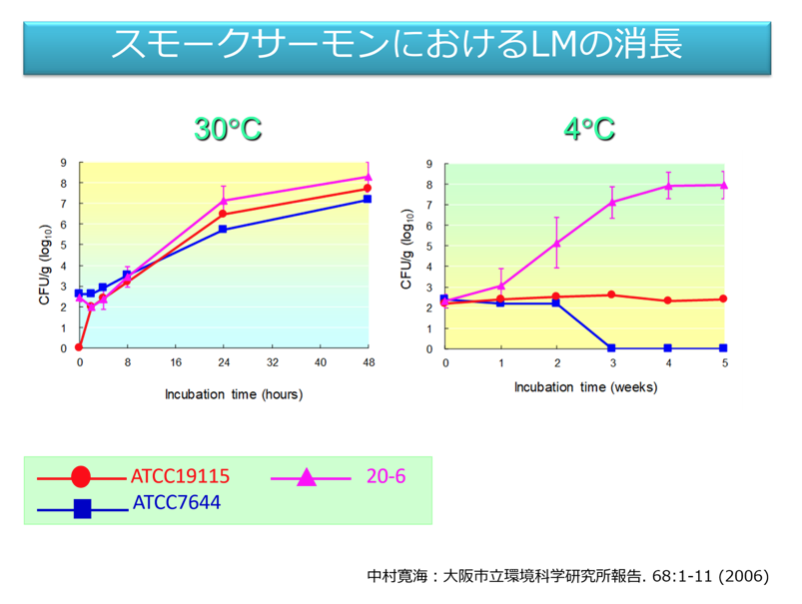
筆者らが2003年から2004年に実施したRTE動物性加工品におけるLM汚染実態調査では、水産加工品、食肉加工品、乳製品の中で、水産加工品のLM陽性率が高かった。RTE食品の種類によってLMの増殖しやすは異なる。供試菌株は辛子明太子、たらこでは30℃で増殖が起きなかったが、スモークサーモンでは全ての菌株が30℃で増殖した。
アメリカでは2015年に発生した食品媒介リステリア症は病院における事例であった。患者4人はいずれも免疫機能を低下させる基礎疾患を有しており、いずれも売店でアイスクリームから作られたミルクシェーキを食べていた。患者から分離されたLMは、この売店にアイスクリームを納入している企業の1工場で製造されたアイスクリームから分離されたLMと同一の遺伝子型であった。そのため、このアイスクリームがリステリア症の原因食品と推定された。
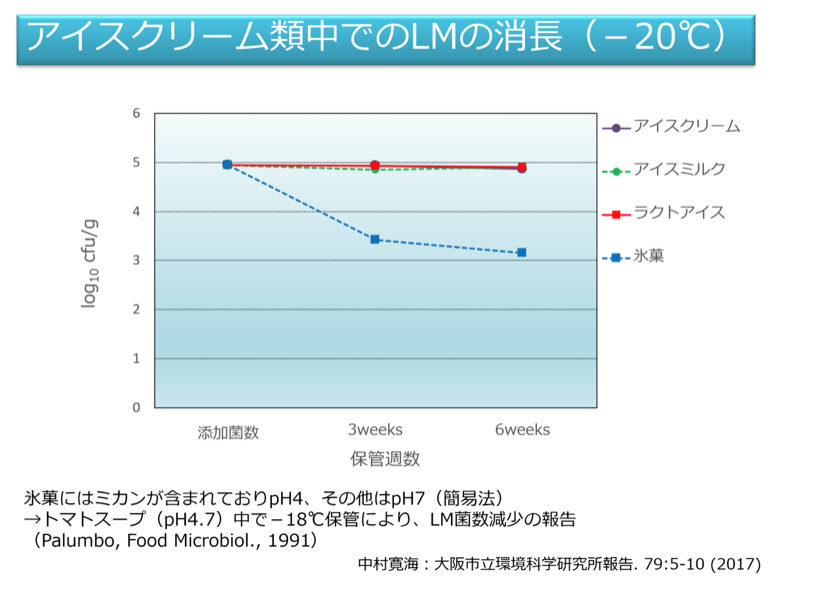 筆者らが実施した国内で販売されているアイスクリーム類17製品を対象とした調査結果では、リステリア属菌の汚染はみられなかった。またこれら製品の製造施設においても大腸菌群やLMを含むリステリア属菌の汚染はみられなかった。しかしながら、LM汚染は低濃度であってもアイスクリーム類中で長期間生菌として存在するため、入院患者や高齢者が喫食する可能性を考えると、これらの食品へのLM汚染には細心の注意を払う必要がある。
筆者らが実施した国内で販売されているアイスクリーム類17製品を対象とした調査結果では、リステリア属菌の汚染はみられなかった。またこれら製品の製造施設においても大腸菌群やLMを含むリステリア属菌の汚染はみられなかった。しかしながら、LM汚染は低濃度であってもアイスクリーム類中で長期間生菌として存在するため、入院患者や高齢者が喫食する可能性を考えると、これらの食品へのLM汚染には細心の注意を払う必要がある。
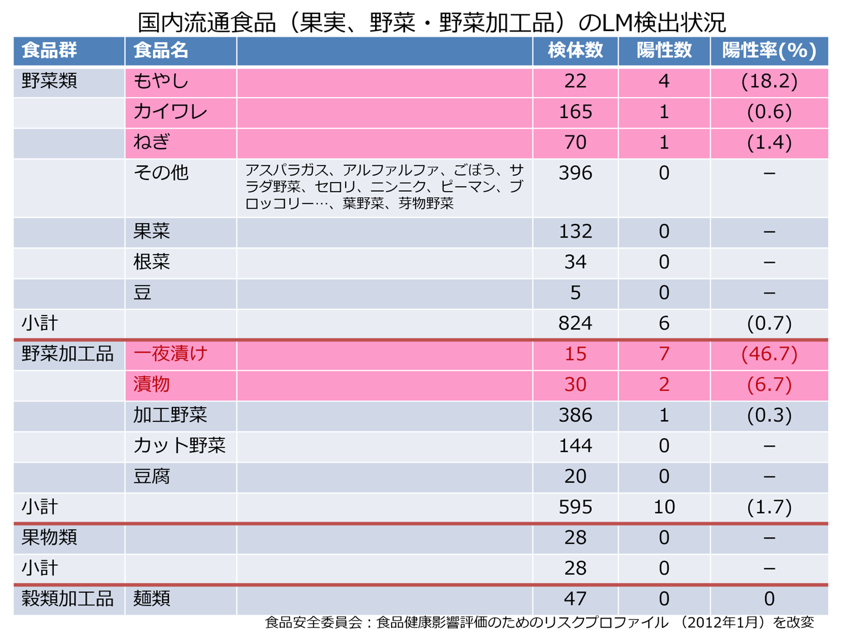
国内を流通するRTE食品においては、浅漬けのLM汚染率が比較的高い。そのため、製品汚染率の高いL社と、衛生管理を徹底しているN社の製造工程、汚染状況、衛生管理手法を比較した。製造工程では2社での大きな違いは見られなかったが、L社では施設内ふき取り検査で21検体のうち7検体、N社では28検体のうち1検体からLMが検出される結果となった。また、清掃マニュアルの有無、作業動線の複雑さ、床の水のたまりやすさなどの違いがみられた。
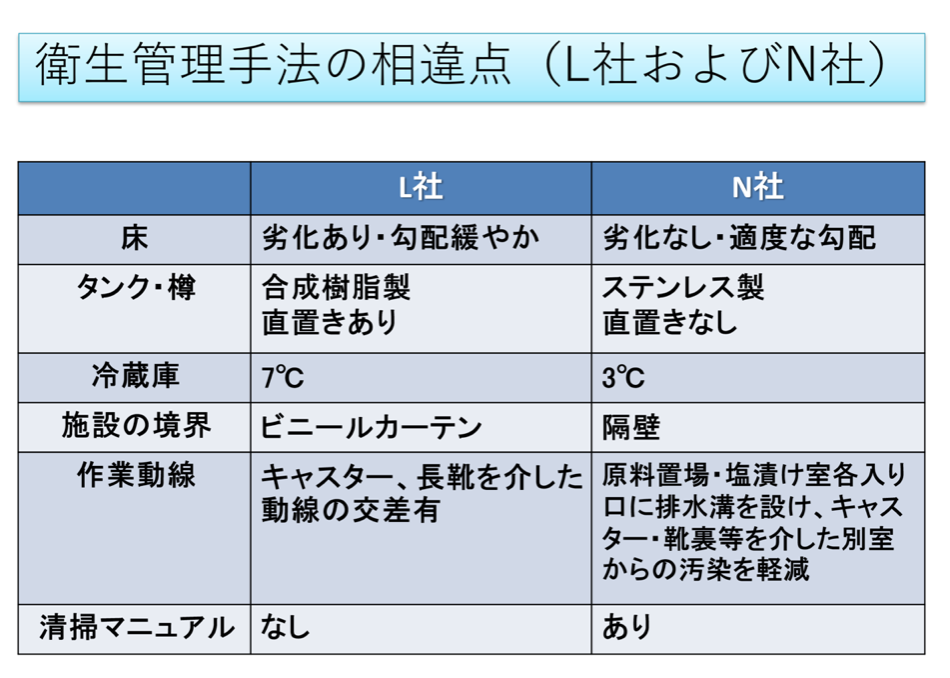
食品の製造施設において、最終製品から高率にLMが検出される場合、当該製品の製造施設内から広範囲にLMが検出される。製造施設のLM汚染を防止するためには、一般的衛生管理の徹底、環境モニタリングの実施や製造ラインへの汚染防止対策に加えて取り扱う食品の特性を知ることが重要となる。
パネルディスカッションより
Q1-1鶏肉におけるLM汚染の対策方法は。
A1-1対LMは熱に弱いので、加熱後に喫食すればリステリア症の感染リスクは低い。 生鶏肉からLMが検出されることがあるが、鶏肉は加熱後に喫食されることが多いため、生鶏肉のLM汚染のヒトへの感染リスクは高くないと思われる。
Q1-2加熱処理工程を行う工場における注意点は。
A1-2加熱処理後の工程管理が重要であり、ヒトや器具等が交差しないように動線に注意し、加熱前の原材料やこれを取扱うエリアから最終製品やこれを取扱うエリアが汚染されないように注意する。
Q1-3たらこでは保存中にLMが減少したのはなぜか。
また衛生管理の観点では、LMの検査を製品と製造ラインのどちらを優先すべきか。
A1-3たらこには多くの添加物が含まれるためLMの増殖が抑えられたと考えられる。増殖はしないが保存後も死滅せずに存在していた。 製品から高率にLMが検出される場合は、これらの製造施設からも同様にLMが高率に検出されることが多い。定期的に製品や製造ラインをモニタリングすることは有効。
Q1-4ふき取り検査でリステリア属菌は検出されていたか。
またリステリア属菌とLMの相関はあるか。
A1-4リステリア属菌とLMを同時に検査した。スモークサーモン製造施設では塩漬室の床から常にどちらも検出された。大腸菌群と一般生菌数はLMの検出と相関はなかった。
Q1-5どうしたらリステリア症の患者数を減らすことができると思うか。
A1-5RTE食品の規格を設定するは一つの策として有効だと思われるが、散発事例のみで原因食品が明らかになっていないわが国の現状では、リステリア症患者数を減らすための対策は難しいと思われる。
講演2
リステリア環境モニタリングの重要性
守山 隆敏
NPO法人 食の安全と微生物検査 理事、ネオジェンジャパン株式会社 シニアアドバイザー
NPO法人 食の安全と微生物検査 理事、ネオジェンジャパン株式会社 シニアアドバイザー
1. リステリア・モノサイトゲネスの主な特徴とリステリア環境モニタリングの重要性
リステリア・モノサイトゲネスはグラム陽性の短桿菌であり、自然界に広く分布する。リステリア・モノサイトゲネスの特徴として、低温増殖性、塩分耐性、潜伏期間が長い、バイオフィルムを形成する菌として知られている。リステリアの増殖リスクが高い食品として、日本において規格基準が設定されているナチュラルチーズ(ソフト及びセミハードのものに限る)や非加熱食肉製品(生ハム)のほか、生野菜、スモークサーモン、漬物、サラダなどがあげられる。これらの食品では食中毒の報告もあり、原材料そのものの汚染だけでなく、製造環境からの二次汚染が原因となる事例も多い。また、冷蔵(4℃)でも増殖することが知られており、冷蔵食品でも輸送管理を含めて注意が必要である。
米国の調査では、リステリア症の感染経路を96%が食品由来としており、欧米では、幅広い食材が原因となり、リステリアによる食中毒により、重篤な症状を引き起こすことでも良く知られている。このことから欧米ではリステリアの環境モニタリング管理が強化され、また規制も実施されている。過去の報告によると、製造環境において微生物汚染が確認された場合、約70%の確率で食品も汚染される可能性があるとの調査があり、ICMSFもHACCP計画や適性衛生基準(GHP)プログラムを最適に適用したとしても、製造環境内で再汚染が発生しないという保証は無いとしている。
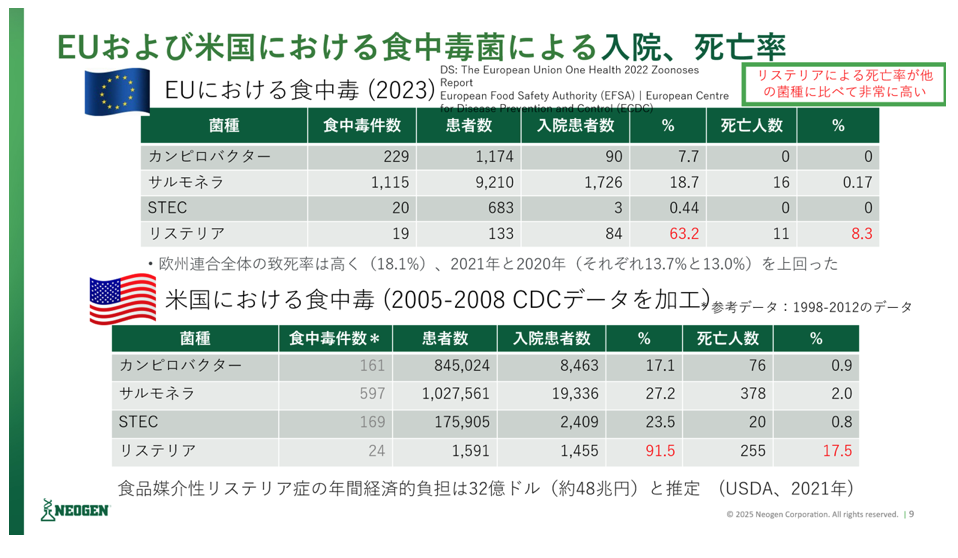
2. 何故、米国やEUではリステリアを重要視しているのか
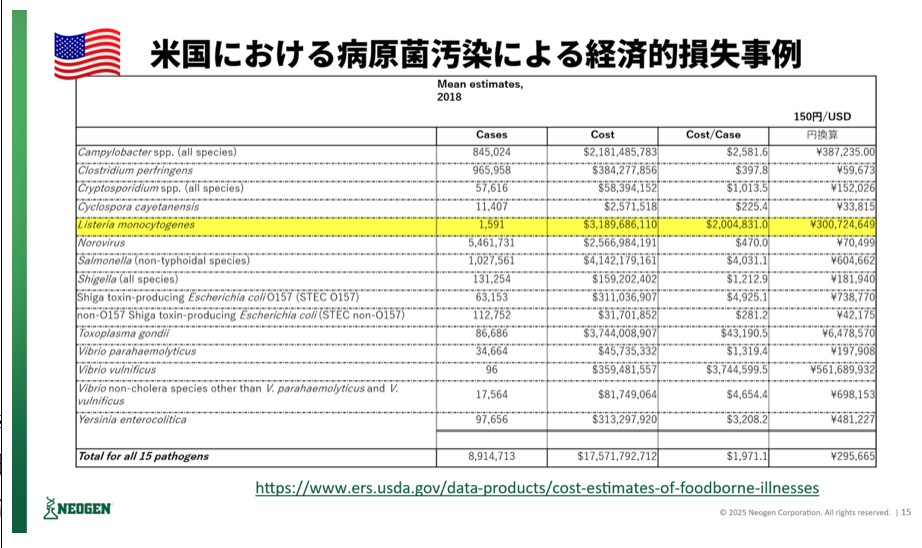
近年の米国やEUでのリステリアによる食中毒事例を見ると、サルモネラやカンピロバクターなど他の病原菌と比較して、重篤になる事例が多く、入院率や死亡率が非常に高い。また、原因食品も多岐にわたり、葉物野菜、アイスクリーム、RTE食品など幅広い食材の汚染からの食中毒の報告がある。リステリア・モノサイトゲネスが陽性となった場合に、自主的に回収(リコール)を実施する例も多い。米国FDAによると、これまでのリコール事例としては、カンタロープメロンやチーズ、スモークサーモンなど多岐に渡る。また、リステリアによる死亡率も他の病原菌と比較して高く、また経済損失も多いことが示されている。こうした背景から、欧米ではリステリアに対する規制強化が進んでいる。
米国では、洗浄プロセスを管理するうえでリステリア属菌の検査は有効としており、インデックス指標菌(基準値検出または存在することにより、生態学的に類似した病原菌が存在するリスクが高いことを示す微生物)として、リステリア属菌の環境モニタリング検査を行うことを推奨しており、食品事業者においてもリスク管理の観点から、リステリアの環境モニタリングを強化し、管理している。
3. 日本においてリステリアへの注目度が高まっている背景
日本におけるリステリアによる食中毒事例は、2001年に北海道でナチュラルチーズを原因とした集団感染の1例のみ報告されているが、リステリア症の件数は約200症例の報告がある。米国CDCによるとリステリア症の約96%が食品由来であるとの報告があることから、日本でも食品由来の可能性も高いものと推測される。また、CODEXの一般原則においてリステリアの管理が重要と示されており、HACCP制度化による工程管理の強化や、リステリア症のリスクが高い高齢者の人口増加も注目すべき点である。世界の環境モニタリングに関して、米国FDA、USDA、Health Canada、EUの規制でも示されている。
GFSIのスキームであるFSSC22000やJFSM規格においても、環境モニタリングの推進や食品安全文化が示されており、リスク管理の一つとして、リステリアの環境モニタリングを実施する食品事業者も増えてきている。現在、日本からの食品輸出の拡大が掲げられており、輸出先の規定等でリステリア試験が求められるケースもある。

4. 環境モニタリングを行うための手順概要
基本的な環境モニタリングのステップは、①ゾーニングと拭き取り箇所の計画、②拭き取りの実施、③試験の実施、④汚染状況の分析、⑤陽性箇所の適切な洗浄・消毒の実施、⑥定期的なモニタリングの実施と維持、で構成される。ゾーニングの基本的な考え方としては、以下の4つに分類される。
ゾーン1 食品が直接接触する面 ゾーン2 食品は直接接触しないが、食品および食品接触面に近接する面 ゾーン3 食品は直接接触しないが、加工エリア内にある区画 ゾーン4 加工エリア外にある区画 特に、ゾーン1は最も重要な箇所であり、ここで病原体(リステリアなど)が確認された場合は対策が急務となる。
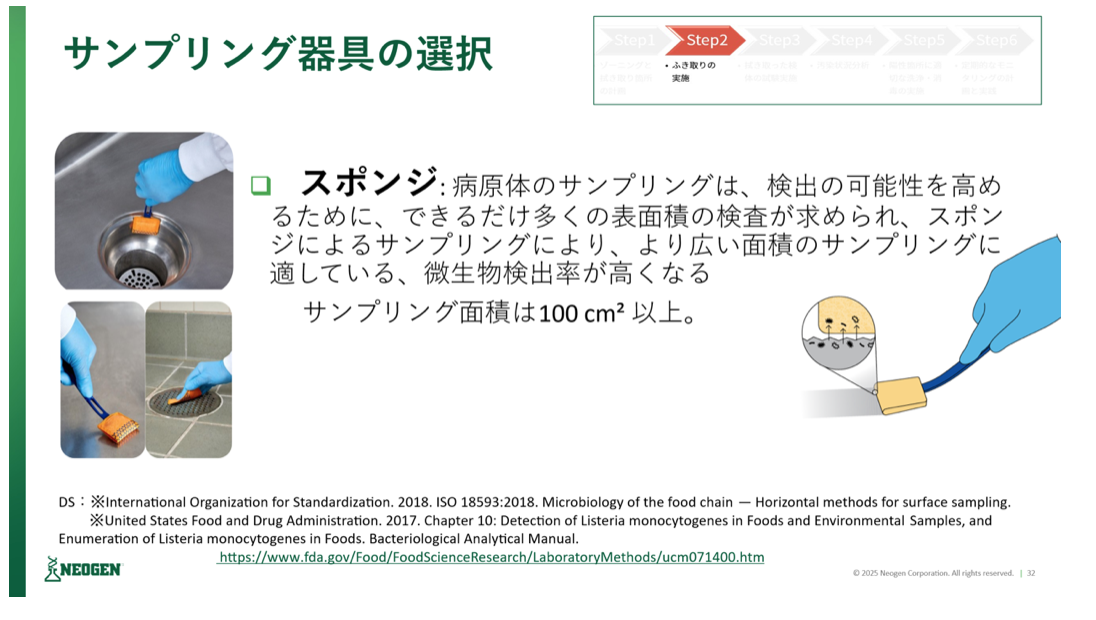
拭き取り検査で用いる主なサンプリング器具は、定量的な環境試験に有効な綿棒と定性的な確認で用いられるスポンジがある。綿棒については、サイズが小さいため、手の届きにくい場所でのサンプリングに適しており、一方、スポンジは、病原体の検出の可能性を高めるためにできるだけ多くの表面積でサンプリングをする場合に適している。
定期的なモニタリングにおいて、目的に応じて方法や頻度、1回あたりの検体数を決定し、陽性が検出された場合には、洗浄や消毒など対策の検討が必要となる。
バイオフィルムやリステリア・モノサイトゲネスへの殺菌効果が確認された殺菌剤について、FDAのガイドラインでは、第四級アンモニウム塩および過酢酸が紹介されており、特にバイオフィルムについては過酢酸が有効との記述もある。

5. その他 事例研究
海外において発生した食中毒事例やリコール事例について紹介する。
2012年から2024年にかけてEUの5か国においてスモークサーモンによる広域食中毒が発生した。患者数はドイツで39名、オランダで20名のほか英国、ベルギーなどでも複数の患者が確認され、合計で73名が罹患し、死者は14名となった。デンマークの加工施設においてリステリア・モノサイトゲネスが繰り返し検出され、施設内の洗浄や消毒が不十分であることが原因と考えられた。また、サケやマスの原材料自体が自然環境由来のリステリアに汚染されていた可能性も推測され、特に魚の皮やエラ表面からも検出された。低温でも増殖可能な菌の特性により、低温流通でも広がった可能性も考えられた。
2021年11月に米国オレゴン州において、リステリア・モノサイトゲネス汚染によるスモークサーモンのリコールが発生した。製品は冷凍で出荷されていたが、原料魚の皮やエラ表面に、自然環境由来のリステリアの付着が確認された。パッキング工程など加工環境での衛生管理不備により、リステリア・モノサイトゲネスが製品に移行したことが推測された。
近年発生したリステリアによる食中毒事例を通じてリスク要因を整理すると、リステリア環境モニタリングは、食品製造現場における「見えないリスク」を可視化し、製品の安全性と企業の信頼性を守るための不可欠な取り組みである。単なる検査ではなく、予防的な品質管理の柱として位置づけ、是正措置と検証を組み合わせて継続的に運用することが重要である。
パネルディスカッションより
Q2-1魚の皮やエラにリステリアがいるというお話だったが、そもそも原材料が汚染されていれば、製造施設を清潔にしていても、原料によってまた汚染されるのではないかと考えるが、製造施設の管理はどのように行えばいいのか? また、最終製品を検査して一定の水準以下のものだけを流通させることくらいしか現実的にできないのではないかと考えるがご意見をうかがいたい。
A2-1魚の皮やエラからのリステリアは、あくまでスモークサーモンから検出されたリステリア・モノサイトゲネスと遺伝子が一致したという話であるが、対策については文献等で示されていないため、推測の範囲となるが、製造施設内の管理については、排水や原材料の取り扱いに注意をおくべきと考える。
Q2-2環境モニタリングでリステリア以外での海外の規制はあるか?また、サンプリングの方法について、リステリアは拭き取りで実施することが多いと思うが、生菌数や腸内細菌科菌群などリステリア以外についても拭き取りで実施するのが一般的か?
A2-2リステリア以外の菌での規制としてはサルモネラがあげられるが、サルモネラについては腸内細菌科菌群として広い範囲で確認することがある。また、サンプリングについて、リステリア以外では衛生指標菌や食中毒菌があげられるが、モニタリングの主たる目的としては食中毒菌が対象となるため、スポンジでの拭き取りが一般的といえる。
Q2-3普段、鶏肉を仕入れて加工後に製品にしているが、原料の鶏肉がリステリアを保有しているケースもあると聞く。弊社での現状の管理は、製品でリステリアの検査しか行っていないが、工場内に菌を持ち込まないことを考えた場合、今後どのような管理を行えばいいのかアドバイスをいただきたい。また、万が一、リステリアが検出された場合、どのような対策を講じればいいか教えていただきたい。
A2-3まずは現状を把握する目的で複数の箇所の拭き取りを行い、検出された場合は洗浄を強化し、定期的にモニタリングを実施することが有効的といえる。
Q2-4リステリアはバイオフィルムを形成するとのお話だが、洗浄の時に気を付けることなどがあれば教えていただきたい。また、バイオフィルムを除去するために、たとえば中性洗剤をアルカリ洗剤にかえるなどの対処が有効か教えていただきたい。
A2-4 製造施設内において菌が付着するとポリマーが産生され、バイオフィルムが形成される。一度バイオフィルムが形成されると洗浄しても簡単には除去できるものではないため、洗浄時に強くこすりながら除去するなどの対処が必要となる。問題なのは、このバイオフィルムが形成されたあとに、ポリマーとともに菌が放出されて、他の場所を汚染することがあるため、注意が必要である。洗浄剤については、種類を変えなければならないという話はでていないが、同じ洗剤を継続的に使用していると濃度が薄くなるため、濃度の管理に注意する必要がある。
Q2-5インデックス指標菌について、サンプリング器具やふき取り対象のゾーン、試験法についてうかがいたい。また、腸内細菌科菌群はあくまで衛生指標菌の一つとして考えればいいか?
A2-5 インデックス指標菌を調査する目的が重要である。検出されてはならない種類が対象であればスポンジを使用し、拭き取りが実施しにくい場所などは綿棒を使用することが有効的と考える。また、腸内細菌科菌群は衛生指標菌の一つとして考えて問題ない。
講演3
リステリア・モノサイトゲネスとリステリア属菌の試験法
岡田 由美子
国立医薬品食品衛生研究所
国立医薬品食品衛生研究所
1. 食品中の微生物を検出する試験法の策定
食品中の微生物試験方法は、その目的により用いるべき(用いてもよい)試験方法が異なり、規格適合性の証明は「公定法」、社内基準適合性の確認(原料の受け入れ基準や製造工程管理など)は「任意の試験法」となる。試験方法は、同じ項目、同じ検体、同じ培地を使ったとしても、その試験方法によって結果に違いが出るため、規格の証明などでは統一(性能が確認)された標準の試験方法を用いることが望ましい。日本国内で用いられている食品中の微生物試験法は、告示法及び通知法等の公定法と、それ以外の試験法(食品衛生検査指針に記載のある試験法、簡易迅速法)がある。
1) 国際的な標準試験法
国際的に用いられている標準試験法は、国際標準化機構の試験法(ISO法)、米国食品医薬品局(FDA)の試験法(BAM法)、米国農務省食品安全検査局(USDA FSIS)の試験法及びAOACの試験法などがあり、国際的な食品の規格基準を定めているCodex委員会ではガイドラインCAC/GL21-1997において、ISO法を国際標準試験法と定めている。
2)日本における標準試験法
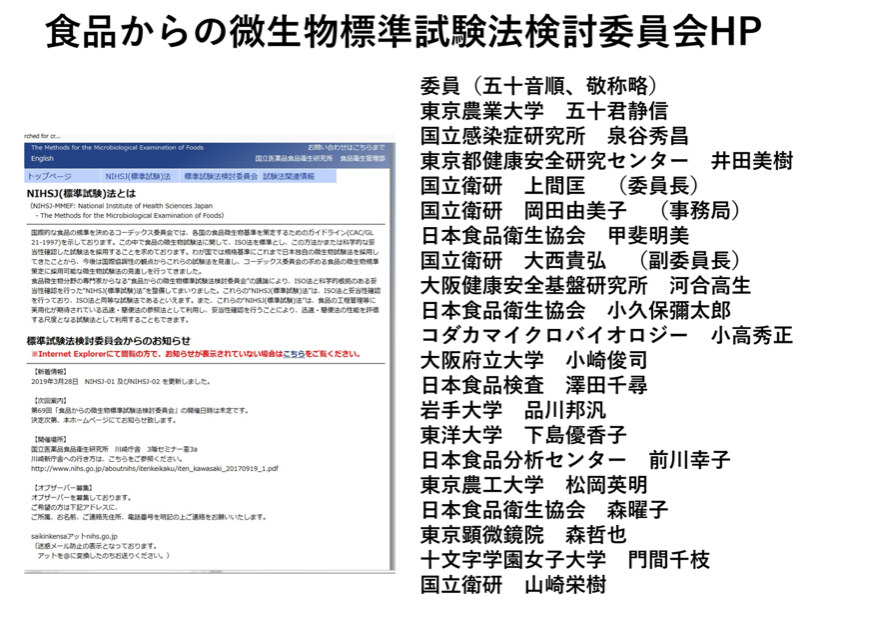
日本の試験法は平成17年より厚生労働科学研究において「食品からの微生物標準試験法検討委員会」が発足した。構成メンバーは食品の微生物検査に関係する専門家、消費者庁食品衛生基準審査課の担当者からなっている。これからの食品の微生物検査について公開の場で議論し、作成したガイドラインに従って、標準試験法を定めることを目的としている。
標準試験法は、培養法を基本とし、国際整合性を重視して作成している。では、なぜ試験法の国際整合性が必要なのか。一つは国際的に用いられている試験法より厳しい(著しく感度が高いなど)試験法を用いている場合、輸入検疫時に非関税障壁ととらえられ、WTOに提訴される可能性がある。
二つ目に、国際的に用いられている試験方法より劣る試験方法を用いている場合、海外で不合格とされる食品が国内に持ち込まれる可能性がある。この二つの理由があるため、消費者庁及び厚生労働省では、微生物試験法の国際ハーモナイゼーションを重視することとしている。
食品からの微生物標準試験方法検討委員会で、現在までに検討されている試験方法には、サルモネラ属菌や黄色ブドウ球菌など、公定法として引用されているものから、技術仕様書として作成されているエンテロバクターサカザキやリステリア属菌等がある。
2. 食品中のリステリア規格基準
Codexが定めた非加熱喫食(RTE)食品中のリステリア規格基準(2009)では、①微生物規格の必要のない食品と②微生物規格が必要な食品とに分けられ、①については、製造工程過程においてL.monocytogenes (以下Lm)を確実に死滅させ、かつ再汚染が起こりえないRTE食品で、Good Hygienic Practice(GHP)のもとで製造加工、取り扱われる食品とされており、例えば包装後加熱の食肉加工品がそれにあたる。
そして②は、まず食品中での増殖があるのかないのかで分けられ、食品中での増殖があるとされる食品では1ロットから5検体数を試験し、その全てが25g中陰性でなくてはならない。食品中での増殖がない食品では、1ロットから5検体数を試験し、その全てが100cfu/g以下となっている。
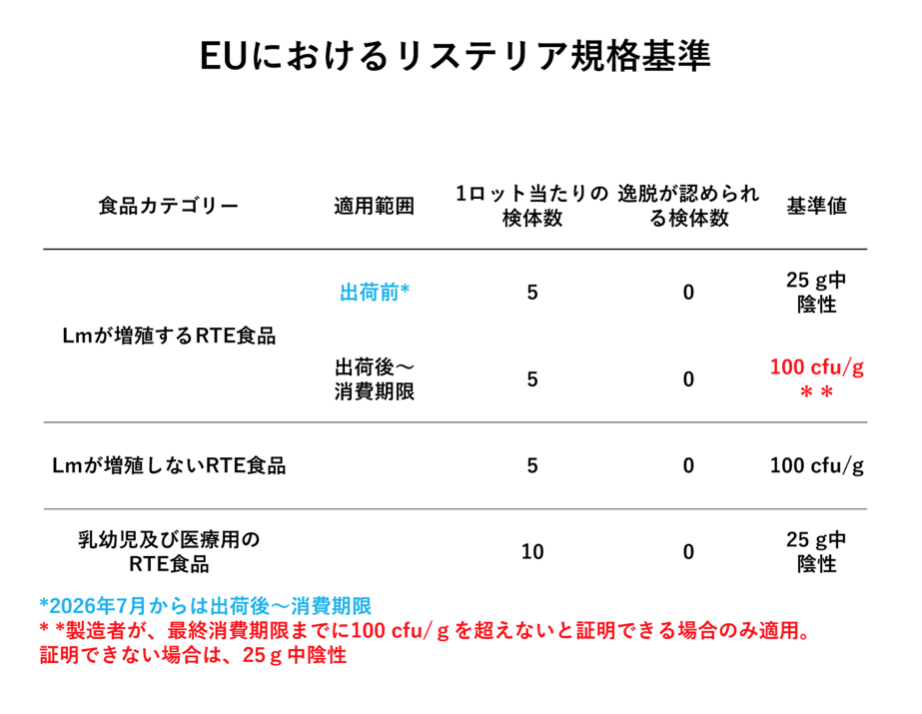
EUにおけるリステリア規格基準は食品カテゴリーが3つに分けられ、①Lmが増殖するRTE食品、②Lmが増殖しないRTE食品、③乳幼児及び医療用のRTE食品となっている。①では、これでまでは食品製造者が消費期限最終時点でLmが100cfu/gを超えないと考えられる食品については、100cfu/g(1ロット当たり5検体を試験し、その全てで基準を満たす)までを可としており、合否判定は出荷時の確認で行われていた。
しかしながら、EUでのリステリア症患者数の増加を受けて規格が厳格化され、2026年7月1日からは出荷後~消費期限最終日まで100cfu/g以下であることを科学的に証明しなければならなくなり、出荷後の保管温度や保管期間のばらつきを考慮すると、Lmが増殖可能な食品で出荷時検査では基準適合性を担保できなくなることから、このような食品では基本的に25g中陰性とすることとなった。
ハイリスクグループ用の食品である③では、1ロット当たりの検体数を10としており、その全てで25g中陰性でなくてはならないとしている。米国におけるリステリア規格基準は、ゼロトレランス政策となっており、リステリアが検出された食品は、流通・販売禁止とし、すでに流通した食品はリコールとなる。
3. 国際的なリステリア試験法
現在、国際的に用いられている試験法はISO11290-1:2017(定性法)、ISO11290-2:2017(定量法)、それと米国食品医薬局(FDA)が定めるBAM Chapter10の試験法、米国農務省食品安全検査局(USDA FSIS)が定めるMLG8.15等が挙げられる。
ISO11290-1:2017はhalf Fraser培地とFraser培地を用いた2段階の増菌培養のそれぞれから2種類の選択分離培地(①ALOA培地、②その他の培地(PALCAM寒天培地、Oxford寒天培地等))に画線塗抹を行ってリステリア属菌を検出する。
BAM法はBLEB基礎培地を用い、4時間培養後に選択剤を加えて24時間及び48時間まで培養して、それぞれエスクリン分解性培地、酵素基質培地の2種類の選択分離培地に画線塗抹を行い、Lmが分離された陽性検体についてMPN法での定量(場合によっては集落係数法も行う)を実施する試験法となっており、定性試験部分では規定された迅速簡易法でのスクリーニングが認められている。
MLG8.15は対象食品がRTE食肉製品、鶏肉、ナマズ、卵製品及び環境検体に限定されており、LPT培地を用いた増菌後に迅速法によるスクリーニングを行って、Lmと推定される集落が検出された場合にはMALDI-TOF MSを用いた同定を行う。
4. 日本におけるリステリア試験法
国内での基準は、対象食品がナチュラルチーズ(ソフト及びセミハード)と非加熱食肉製品で、1ロット当たりの検査数は5で、その全てにおいて100cfu/g以下となっている。また、輸入検疫においては加熱をせずに食する冷凍野菜及び冷凍果実並びに無加熱摂取冷凍食品(野菜加工品、果実加工品に限る)からLmが100cfu/gを超えて検出された場合にも、食品衛生法第6条第3号に違反するものとして取り扱うこととなっている。
Lmの試験法は定性試験のNIHSJ-08:2020と定量試験のNIHSJ-09:2020の2種類あり、非加熱食肉製品及びナチュラルチーズ(ソフト及びセミハード)の公定法として引用されている。リステリア属菌の試験法については、食品製造環境の汚染指標としてリステリア属菌を用いるため、ISO11290:2017では試験対象としてListeria spp.も含むこととなった。
国内では令和3年度のHACCP完全制度化に伴い、製造工程の衛生管理項目の一つとしてリステリア属菌を衛生指標とすることへの関心が高まっている。そのため、「食品からの微生物標準試験法検討委員会」では、2023年リステリア属菌作業部会を発足し、ISO11290に準拠した技術仕様書の策定について検討を行っている。


パネルディスカッションより
Q3-1魚の皮やエラにリステリアがいるというお話だったが、そもそも原材料が汚染されていれば、製造施設を清潔にしていても原料によってまた汚染されるのではないかと考えるが、製造施設の管理はどのように行えばいいのか?また、最終製品を検査して一定の水準以下のものだけを流通させることくらいしか現実的にできないのではないかと考えるがご意見をうかがいたい。 (守山隆敏先生へのQ1と同じ質問について、2名の演者から発言がありました。)
A3-1原材料の一次汚染を防ぐのは難しいと思われる。製造施設に一旦入ってしまうと長期定着する可能性があるので、受け入れの段階でなるべく汚染が低いものを使用する必要があると考えている。
Q3-2 リステリアの検査法においてEU規格では来年からN=5で陰性(/25g)を求めるようになると把握しているが、ISO法(2020年版)で試験した結果、あるいは国内で採用される予備試験法での結果をEUは受け入れるのかどうかご意見を伺いたい。
A3-2EU規格について、これまでは消費期限までに100 CFU/gを超過しないと担保できれば良いという規格であったが、リステリア患者数が減少していない状況にある。そこで消費までに100CFU/gを超えないと確信できる場合以外は陰性を要求しており、どの製造者も陰性を取らざるを得ない状況と考えている。国内試験法における予備試験について、EUが受け入れるかどうかは不明である。
Q3-3普段、鶏肉を仕入れて加工後に製品にしているが、原料の鶏肉がリステリアを保有しているケースもあると聞く。弊社での現状の管理は、製品でリステリアの検査しか行っていないが、工場内に菌を持ち込まないことを考えた場合、今後どのような管理を行えばいいのかアドバイスをいただきたい。また、万が一、リステリアが発生した場合、どのような対策を講じればいいか教えていただきたい。 (守山隆敏先生へのQ3と同じ質問について、2名の演者から発言がありました。)
A3-3市販鶏肉の4割程度で検出されるが、汚染濃度としては定量法で見ると下限値以下である。製造施設に持ち込まれることは防げないので、高圧洗浄など広く汚染を広げてしまう方法を避けること、汚染が想定される箇所のモニタリングを強化することなどが必要と考える。
Q3-4リステリア検出用寒天地であるALOAやクロモアガーリステリア、パルカム寒天培地、オックスフォード寒天培地などのメリット、デメリットについて教えていただきたい。
A3-4ALOAやクロモアガーなどの酵素基質培地はリステリアモノサイトゲネスを見分けやすい点がメリットであるが、選択性が弱い。一方のパルカム寒天培地、オックスフォード寒天培地などは選択性が高いため夾雑菌の発育は抑制される点がメリットであるが、定型集落がリステリアモノサイトゲネスかその他のリステリア属菌かを見分けることができない。このため定性試験において2種類の培地を併用することが必要とされる。
Q3-5現在、国内ではナチュラルチーズと非加熱食肉製品についてのみ規格基準が存在するが、社会情勢の変化やリステリア認知度が上がってきていることを踏まえ、スモークサーモンなど他の製品にも対象を広げる必要があると考えるか、教えていただきたい。
A3-5高齢者人口の増加や基礎疾患を持つ人が増えてきていることは事実である。JANISなどのデータからリステリア患者が増えてきている状況にあるので、(個人的な見解にはなるが)汚染度の高い食品に対象を広げても良いと考えている。
Q3-6現在、リステリア属菌試験法の整備を進めているとのことであるが、リステリア属菌が検出された場合の対処法についても検討されているのか教えていただきたい。
A3-6検討委員会では試験法のみを検討しているので、検出時の対処法については事業者の考え方によると考えている。
Q3-7製品検査や環境モニタリングの結果から、日本でもリステリアモノサイトゲネスのリスクが想定されると思うが、なぜ食中毒として顕在化しないのか知見があれば教えていただきたい。
A3-7「食中毒統計に出ていない=食中毒がない」、と考えがちであるが、実際のところ欧米でもリステリア症の大部分が散発事例となっている。これらを結び付けて集団事例を見つけ出す手段として現在ではゲノム解析が行われている。日本では患者由来株を解析するシステムが存在しないので、散発事例としては年間数百例あるが、これらの中から集団事例を見つけることができないのが現状である。一方、日本では賞味期限・消費期限が短めに設定されていることも、大規模な食中毒が発生しにくい要因として考えられる。
Q3-8リステリア検査法は国によって異なると思うが、食品を輸出する際に日本の方法で試験しても問題がないのか教えていただきたい。
A3-8相手国がどのような試験法を要求しているかに依存する。ISO法を要求しているのであれば、ISO法に準拠している国内の公定法を使うことができるが、他の試験法を求める場合には使えない。
Q3-9将来的にリステリアモノサイトゲネスの検査(管理)は鶏肉(食肉)処理場ではどのような意義があると考えるか。積極的に取り入れた方が良いのか知見があれば教えていただきたい。
A3-9食肉および食鳥処理場でリステリア検査をすべきか、という趣旨と理解するが、RTEではないものでは必須という訳ではないと考える。
Q3-10現在、リステリア属菌の試験法を検討されているとの話であるが、基本的にはISO法を基にされるとのお話であった。その際に用いる酵素基質培地もISO法と同様にALOAやクロモアガーを使用するという方針であるのか教えていただきたい。
A3-10基本的にはISO法に記載される培地(ALOAなど)を使用することを考えている。
Q3-11今後、ISO法でハーフフレーザーの組成変更を考えているとの話であったが、この理由について教えていただきたい。
A3-11これまでの知見から、ハーフフレーザーの組成がリステリア属菌の増菌にとって抑制が強すぎるということが判明している。同時に定量法と定性法を実施した場合に、下限値が高い定量法では検出されるが、下限値の低い定性法で検出されないという現象が生じる場合がある。これは食品中などのリステリアが損傷を受けている場合に、ハーフフレーザーやフレーザー中の成分がリステリアの生育も抑制していることが考えられており、これを改善するための変更が検討されている。ISO法が改訂された場合は、ISO法に準拠しているNIHSJ法と公定法も改訂が必要となる。
Q3-12リステリアの規格基準や環境モニタリングに関する要件は、主に喫食前に加熱を要しない調理済み食品(RTE食品)を対象としているが、それ以外の食品、例えば喫食前に加熱を要する食品(農産物など)について、①RTE食品を製造していない施設においても、リステリアモノサイトゲネスやリステリア属菌の環境モニタリングは必須と考えるべきか、②また、検出された場合の対処法をどのように考えるべきなのか、教えていただきたい。
A3-12 USでもRTE食品でない食品を製造している施設で環境モニタリングを必須としている訳ではないと認識している。ただしリコール対象の中には、「えのきだけ」などが含まれている。アジア圏では生で喫食することは無いが、USではサラダなどのトッピングとして生で喫食してしまう方がいる。また、生で喫食しない場合でも交差汚染により感染した事例もあるのでリコール対象になる事がある。(特殊な例ではあるが)このような場合には、環境モニタリングを行うことも考慮する必要があると考えている。検出時には、施設設備の洗浄、消毒が必要となる。
Q3-13RTE食品についてスパイク試験により、現状のpHで期限内にリステリアが増殖しないことを確認しているため、日々の検査では一般生菌数が100 CFU/gを超えないことを確認することで、リステリア検出も規格基準内であるという管理の考え方でも問題がないか教えていただきたい。
A3-13 断定はできないが、一般生菌数の結果をもってリステリアが基準内であるという管理方法は適切でないと考えられる。
Q3-14 JEMRAでのRTE食品のリスク評価を受けた日本国内の動きについて教えていただきたい。
A3-14 現状では行政的な管理に取り入れる動きはない。ただし、CODEXにおいてガイドライン改訂の検討が行われているため、これが出た際には影響を及ぼす可能性は考えられる。
